AUGENERKRANKUNGEN
weitere Krankheitsbilder...
Grauen Star (Cataract) - Text folgt
Webserie "Augenzentrum informiert" - Thema GLAUKOM (Grüner Star), mit PD Dr. med. Karl-Georg Schmidt.
GLAUKOM (Grüner Star)
PD Dr. med. Karl-Georg Schmidt
Definition
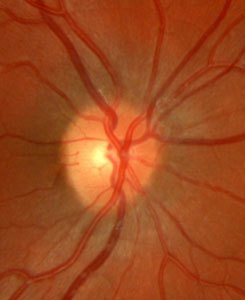
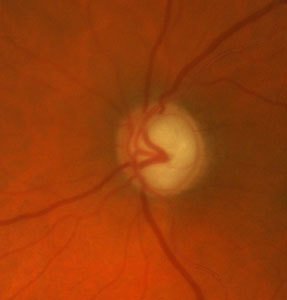
Der grüner Star (Glaukom), eine Erkrankung des Sehnervs, ist eine der häufigsten Erblindungsursachen in den Industrienationen. Das Glaukom verläuft meist schmerzlos, schleichend und anfangs unmerklich. Charakteristisch ist ein kontinuierlicher, unwiederbringlicher Verlust von Sehnervenfasern. Diese Nervenfasern sind für die Weiterleitung der Sehreize zum Gehirn verantwortlich. Je mehr Nervenfasern untergehen, umso weniger Sehreize erhält das Gehirn vom Auge zur Bildverarbeitung. Als Folge entstehen charakteristische Gesichtsfeldausfälle, die unbehandelt zur Erblindung führen. Dieser Verlust von Sehnervenfasern ist am Sehnervenkopf (Papille) im fortgeschrittenen Stadium als zunehmende Aushöhlung (Exkavation) erkennbar.
Anatomie
Anatomisch
werden Offenwinkel- und Engwinkel-Glaukome unterschieden. Diese
Einteilung basiert auf dem Winkel zwischen Hornhautrückfläche und
Irisvorderfläche. Im so genannten Kammerwinkel befindet sich das
Trabekelwerk, durch das das Kammerwasser das Auge über den Schlemm-Kanal
verlässt.
Offenwinkelglaukome sind weit häufiger und verlaufen meist
über viele Jahre, sind schmerzfrei und bleiben daher häufig unbemerkt,
während die selteneren Engwinkelglaukome zum schmerzhaften Glaukomanfall
führen können, bei dem unbehandelt innerhalb kurzer Zeit eine
Erblindung droht. Weitergehende Informationen können Sie bei den unten aufgeführten Weblinks und Literaturhinweisen entnehmen.
Häufigkeit
In
der Schweiz ist das Glaukom eine der häufigsten Erblindungsursachen.
Zwei von hundert Personen ab 40 Jahren erkranken am grünen Star, 50.000
Schweizer leiden nachweislich an einem durch erhöhten Augeninnendruck
verursachten Glaukom, 10 Prozent davon droht die Erblindung. Patienten
mit Glaukom bei normalem Augeninnendruck (Normaldruckglaukom, ca. 30 –
45% aller Glaukome) sind in dieser Untersuchung nicht erfasst. Die
Schweizerische Ophthalmologische Gesellschaft (SOG) weist darauf hin,
dass die Dunkelziffer in diesem Bereich sehr hoch ist. Es wird davon
ausgegangen, dass in der Schweiz insgesamt etwa 100.000 Menschen von
einem Glaukom betroffen sind.
Augeninnendruck
Im
Ziliarkörper des Auges wird das Kammerwasser produziert und an die
hintere Augenkammer des Auges abgegeben. Es gelangt durch die Pupille in
die vordere Augenkammer und fließt durch das Trabekelwerk über den
Schlemm-Kanal ab. Das Verhältnis von Kammerwasserproduktion zu
Kammerwasserabfluss bestimmt den Augeninnendruck. Der normale
Augeninnendruck liegt zwischen 10 und 21 mm Hg, Schwankungen im
Tagesverlauf um bis zu 5 mm Hg sind normal. Der Augeninnendruck steigt
bei Europäern mit dem Alter an.
Ursachen
Eine
Ursache für das Offenwinkelglaukom ist eine chronische
Durchblutungsstörung des Sehnervs, die häufig durch einen erhöhten
Augeninnendruck hervorgerufen wird. Ursache eines erhöhten
Augeninnendruckes ist eine Störung des Kammerwasserabflusses aus der
vorderen Augenkammer. Dadurch ergibt sich eine Druckerhöhung im Auge die
zu einem erhöhten Druck auf die empfindlichen Sehnervenfasern führt.
Der Sehnervenkopf, die Stelle, an der alle Nervenfasern der Netzhaut
zusammenlaufen und das Auge in Richtung Gehirn verlassen, ist besonders
sensibel. Werden die Nervenfasern an dieser Stelle nicht mehr genügend
mit Sauerstoff und anderen Nährstoffen versorgt, sterben diese bei
entsprechend langer Unterversorgung ab.
Bei ausreichender
Durchblutung der Gefäße des Sehnervenkopfes kann ein höherer
Augeninnendruck toleriert werden, bei niedriger Durchblutung kann
bereits ein niedriger Augeninnendruck zum Fortschreiten eines Glaukoms
führen (Normaldruckglaukom). Besonders ungünstig ist die Verbindung aus
hohem Augeninnendruck und niedriger Durchblutung des Sehnervenkopfes. Da
sowohl Augeninnendruck als auch Durchblutung schwanken können, ist
sowohl der absolute Wert beider Parameter als auch die Dauer ungünstiger
Druck- bzw. Durchblutungsverhältnisse von Bedeutung.
Alle
Bedingungen, die einerseits zu erhöhtem Augeninnendruck oder
andererseits zu reduzierter Durchblutung des Sehnervenkopfes beitragen,
können also ein Glaukom verursachen. Zu den ersteren zählen vor allem
Störungen in der Funktion des Trabekelwerks, der (zu) niedrige Blutdruck
oder der überbehandelte Bluthochdruck und andere Erkrankungen, die die
Durchblutung einschränken (Arteriosklerose, Herzrhythmusstörungen,
Diabetes mellitus etc).
Insbesondere Phasen zu starker nächtlicher Blutdruckabsenkung können hier zu einer Verschlechterung der Erkrankung beitragen.
Neurodegeneration und oxidativer Stress beeinflussen zusätzlich das Krankheitsgeschehen.
Die individuelle Kombinationen dieser Faktoren definiert die kritische Schwelle, die das Fortschreiten des Glaukoms bestimmt.
Die
Schädigung des Sehnervs beim Glaukom, sichtbar an einer
charakteristischen Aushöhlung des Sehnervenkopfes, betrifft zuerst die
Nervenfasern der mittleren Netzhautperipherie und schreitet langsam zum
Zentrum hin fort. Sind etwa 70% der Nervenfasern betroffen, bilden sich
bogenförmige Gesichtsfeldeinschränkungen im mittleren Gesichtsfeld aus,
die selbst im fortgeschrittenen Stadium vom Patienten oft nicht
wahrgenommen werden.
Der Augeninnendruck kann mit
unterschiedlichen Methoden erfasst werden (Applanationstonometrie nach
Goldmann, Pneumotonometrie). Dabei wird die Kraft gemessen, die für eine
definierte Abplattung (mechanisch oder per Luftstoß) der – zuvor
medikamentös betäubten – Hornhaut erforderlich ist. Das Messergebnis
wird von der Hornhautdicke des Patienten beeinflusst. Bei einer dickeren
Hornhaut werden höhere Werte, bei einer dünneren Hornhaut niedrigere
Werte als tatsächlich vorhanden gemessen. Daher ist eine zusätzliche
Messung der Hornhautdicke erforderlich, der tatsächliche Augeninnendruck
muss über einen entsprechenden hornhautspezifischen Korrekturfaktur aus
den Rohdaten der gemessenen Druckwerte errechnet werden. Da der
Augeninnendruck im Tagesverlauf schwankt, können mehrere, über den Tag
und ggf. die Nacht verteilte Messungen erforderlich sein (Tages- und
Nachtdruckprofil).
Die alleinige Messung des Augeninnendruckes
genügt weder für Diagnosestellung bzw. -ausschluss noch zur
Verlaufsbeurteilung. Folgende zusätzliche Untersuchungen sind ergänzend
erforderlich:
Messung der Durchblutung des Sehnervs
Messung
und Beurteilung des Augenhintergrundes im dreidimensionalen Bild: Das
Ausmaß der Schädigung des Sehnervens wird anhand der Größe und Form der
Aushöhlung des Sehnervenkopfes bestimmt. Der eigentliche Wert dieser
Untersuchungen liegt in der reproduzierbaren Verlaufsuntersuchung, die
eine frühzeitige Therapieanpassung ermöglicht
Gesichtsfelduntersuchung: Gesucht wird nach charakteristischen, bogenförmigen (glaukomtypischen) Ausfällen.
Primär chronisches Offenwinkelglaukom
Als
primäre Offenwinkelglaukome werden Offenwinkelglaukome bezeichnet, die
nicht als Folge einer anderen Augenerkrankung auftreten.
Das
primär chronisches Offenwinkelglaukom ist die häufigste Form des
Glaukoms. Typischerweise tritt es ab dem 40. Lebensjahr auf, kann aber
schon früher beginnen. Familiäre Häufung, also eine veranlagungsbedingte
(genetische) Komponente, ist bekannt. Bei dieser Form des Glaukoms
kommt es zu einer Abflussbehinderung direkt im Abflussbereich des
Kammerwinkels durch degenerative Veränderungen. Der Druck im Augapfel
erhöht sich langsam über Jahre, der Patient hat in der Regel keine
Beschwerden.
Eine besondere Form des primär chronischen
Offenwinkelglaukoms ist das Normaldruckglaukom. Hier tritt eine
fortschreitende Sehnervenschädigung trotz überwiegend normaler
Augeninnendruckwerte auf. Durch verschiedene Faktoren wird die lokale
Durchblutung am Sehnervenkopf so eingeschränkt, dass die Sehnervenfasern
ebenfalls geschädigt werden.
Angeborenes (juveniles, kongenitales) Glaukom
Durch Entwicklungsstörungen des Kammerwinkels während der Embryonalzeit kommt es zu einer Abflussstörung des Kammerwassers. Dies kann in Kombination mit anderen Fehlbildungen des Körpers auftreten. Der erhöhte Augeninnendruck kann zu einer ein- oder beidseitigen Vergrößerung des Augapfels führen. Bei Verdacht auf ein angeborenes Glaukom muss frühzeitig eine Untersuchung, Augeninnendruckmessung und ggf. rechtzeitige Operation durchgeführt werden, um eine Schädigung des Sehnervs zu verhindern.
Sekundäre Offenwinkelglaukome
Entstehen Offenwinkelglaukome als Folge anderer Erkrankungen, spricht man von sekundären Offenwinkelglaukomen. Dies ist der Fall bei Verletzungen oder Entzündungen des Auges, intraokularen Tumoren, bei Gefäßneubildungen im Kammerwinkel z.B. infolge eines Diabetes mellitus oder bei entsprechend veranlagten Menschen nach Einnahme bestimmter Medikamente (z.B. Kortison), sog. Steroid-Respondern.
Engwinkelglaukom
Das Engwinkelglaukom entsteht durch eine Abflussstörung des Kammerwassers als Folge eines engen Winkels zwischen Regenbogenhaut und Hornhaut, also vor dem Trabekelwerk. Das Ausmaß der Verengung kann schwanken z.B. durch die Veränderung der Pupillenweite und damit der Dicke der Regenbogenhaut. Durch die Abflussstörung kommt es periodisch oder ständig zu einem erhöhten Augeninnendruck, der schließlich zur Sehnervenschädigung führt. Menschen mit höherer Weitsichtigkeit (kürzeres Auge: engerer Kammerwinkel) und fortgeschrittenem grauen Star (dickere Linse) sind eine Risikogruppe. Bestimmte Medikamente (Anticholinergica – z.B. einige Antidepressiva oder Antiemetika) können zu einer Pupillenerweiterung und damit zu einem Augeninnendruckanstieg und evtl. zu einem Glaukomanfall führen.
Glaukomanfall
Der Glaukomanfall beruht auf einer plötzlichen Verminderung des Kammerwasserabflusses aufgrund einer Verlegung des Kammerwinkels durch die Iris. Als Folge steigt der Augeninnendruck stark an, der betroffene Augapfel fühlt sich beim Tasten häufig steinhart an. Typische Beschwerden sind: Plötzlicher Sehverlust, Sehen von Farbringen im Gegenlicht, starke Kopfschmerzen, Übelkeit, Erbrechen und evtl. Herzrhythmusstörungen. Meist ist nur ein Auge betroffen. Der Anfall kann nach wenigen Stunden auch ohne Behandlung abklingen und in Abständen wiederkehren aber auch – unerkannt – über Tage anhalten.
Behandlung
Die Behandlung beginnt mit Augentropfen (Wirkstoffe: Beta-Blocker, Cholinergika, Alpha-Sympathomimetika, Carboanhydrasehemmstoffe, Prostaglandine), die mit unterschiedlichem Wirkansatz allein oder in Kombination den Augeninnendruck senken und teils die Durchblutung des Sehnerven verbessern.
Bei Sekundärglaukomen kann zusätzlich die Therapie der Grunderkrankung erforderlich sein.
Stellen sich medikamentös keine befriedigende Augeninnendrucksenkung und Durchblutung ein, muss zügig ein für den Patienten geeignetes Operationsverfahren (Laser, chirurgisch) gewählt werden. Zusätzlich kann der Augeninnendruck nach Durchführung einer Operation des grauen Stars sinken, da die verwendete Kunststofflinse eine geringere Dicke als die eigene Linse hat und somit indirekt Platz am Kammerwinkel geschaffen wird.
Vorsorge
Vorsorgeuntersuchung ist bei folgenden Risikofaktoren sinnvoll:
- Verminderte
Durchblutung des Sehnervs – häufig bei Durchblutungsstörungen
(Vasospasmen) an den Gliedmaßen (kalte Hände / Füße) Migräne, Tinnitus
- Relativ oder absolut erhöhter Augendruck
- Hohes Lebensalter
- Hohe Kurzsichtigkeit (Offenwinkelglaukom)
- Hohe Weitsichtigkeit (Engwinkelglaukom bzw. Glaukomanfall)
- Niedriger und schwankender Blutdruck (Normaldruckglaukom)
- Hoher Blutdruck
- Familiäre Veranlagung
- Diabetes mellitus
Weblinks
http://www.glaukompatienten.ch
Patienteninfo
Glaukom und Leitlinie vom Berufsverband der Augenärzte (BVA) und der
Deutschen Ophthalmologischen Gesellschaft (DOG)
www.glaukom.de – Initiativkreis Glaukomfrüherkennung e.V.
Deutsches Grünes Kreuz: Glaukom sowie kostenlose Glaukom-Hotline
Literatur
AMD
Die altersabhängige Makuladegeneration
PD Dr. med. Karl-Georg Schmidt
Definition der AMD
Die
altersabhängige Makuladegeneration (AMD) ist eine fortschreitende,
degenerative Erkrankung der Augen, bei der das Zentrum des schärfsten
Sehens, die Makula (der „gelber Fleck“), geschädigt wird.
Die AMD ist
die Hauptursache für den gravierenden Verlust des Sehvermögens
(Sehschärfe) in der westlichen Bevölkerung über 65 Jahre.
Die gesunde Makula ermöglicht sowohl das scharfe Sehen wie auch das Farbensehen.
Bis
heute gibt es keine Therapie, die diese Erkrankung heilen kann. Häufig
kann aber ein Fortschreiten der AMD durch eine geeignete form- und
stadienabhängige Therapie verhindert oder zumindest verzögert werden.
Grundsätzlich
werden zwei Formen der AMD, die mildere, trockene (nicht-neovaskuläre,
d.h. ohne Gefäßneubildung) und die aggressivere, feuchte (neovaskuläre,
d.h. mit Gefäßneubildung) AMD unterschieden. Beiden gemeinsam
vorausgehend ist der Untergang einer bestimmten Zellschicht, des
retinalen Pigmentepithels, das die Ernährung der Makulazellen steuert.
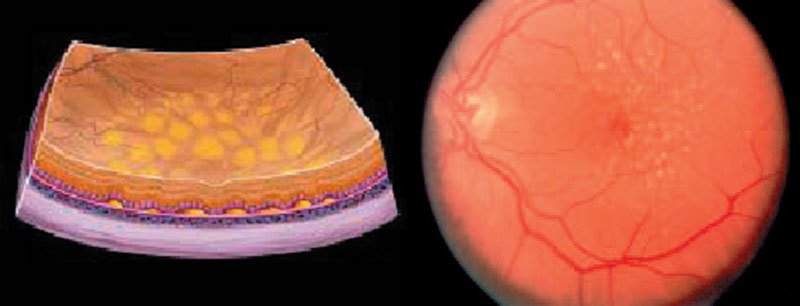
Grundlagen der AMD
Die Makula des gesunden Auges besteht aus Photorezeptoren, die als Schicht über dem retinalen Pigmentepithel (RPE) und der Aderhaut (Choroidea) liegen (Abbildungen 1 & 2). Die Aderhaut ist gefäßreich und versorgt die Makula mit Sauerstoff und Nährstoffen. Dies erfolgt über das retinale Pigmentepithel, das Sauerstoff und Nährstoffe aus der Aderhaut in die Makula transportiert und toxische Stoffwechselendprodukte (den Zellmüll) abtransportiert.
Rechts: Schematische Darstellung eines Normalbefundes mit gesunder Makula
Im Laufe des Lebens nimmt die Anzahl der Zellen im retinalen Pigmentepithel ab.
Gehen
(zu) viele Zellen im retinalen Pigmentepithel unter (Vorstufe der AMD),
kann das retinale Pigmentepithel nicht mehr ausreichend Sauerstoff und
Nährstoffe in die Makula transportieren, toxische
Stoffwechselendprodukte werden nicht mehr ausreichend abtransportiert,
die Makulazellen „verhungern“ und „vergiften“, die (trockene) AMD
beginnt. Je früher hier eine entsprechende Therapie (s.u.) einsetzt d.h.
je weniger Sinneszellen bei Behandlungsbeginn zugrunde gegangen sind,
desto eher lässt sich die AMD und damit die Verschlechterung des
Sehvermögens mit den meist erheblichen Folgen für die Lebensqualität
aufhalten bzw. verzögern.
Da sich die AMD, wie bereits erwähnt, nicht
heilen, wohl aber häufig aufhalten lässt, ist eine frühzeitige Diagnose
und Therapie besonders wichtig.
Ursachen
Entscheidend für das Absterben der Sinneszellen der Makula ist die abnehmende Zufuhr von Sauerstoff und Nährstoffen und die Anhäufung von toxischen Stoffwechselendprodukten. Ursache ist der Untergang des retinalen Pigmentepithels als Folge eines vermehrten oxidativen Stresses (vermehrte Bildung von freien Radikalen). Sind entsprechend viele Zellen des retinalen Pigmentepithels untergegangen kann diese Zellschicht nicht mehr ausreichend Sauerstoff und Nährstoffe in die Makula transportieren und die Abfallprodukte des Makulastoffwechsels nicht mehr vollständig abtransportieren, es kommt zur Einlagerung dieser Abfallprodukte unter das retinale Pigmentepithel im Maculabereich (Drusen), die Nährstoffsituation in der Makula verschlechtert sich zunehmend, die Makulazellen „verhungern“, „vergiften“ und sterben ab, die (trockene) AMD beginnt.
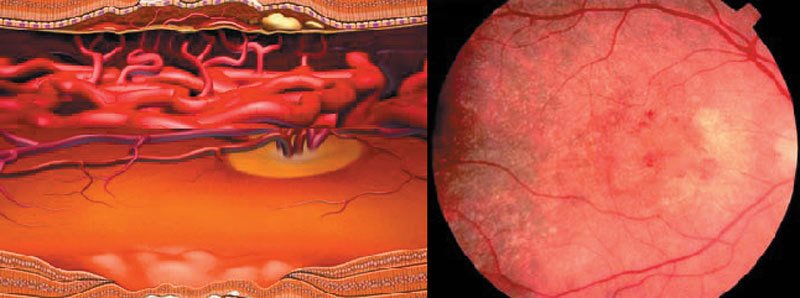
Die trockene AMD
Links: Schematische Darstellung von Netzhautveränderungen eines Auges mit trockener (nicht-neovaskulärer) AMD, es zeigen sich Drusen (nicht abtransportierte gelbliche Abfallprodukte des Makulastoffwechsels als Folge eines Unterganges (oxidativer Stress durch nährstoffmangelbedingte vermehrte Bildung freier Radikale) des retinalen Pigmentepithels unter der Makula
Rechts: Fundusaufnahme eines Auges mit trockener (nicht-neovaskulärer) AMD mit Drusen
Auch wenn die Erkrankung anfangs „nur“ ein Auge betrifft, besteht die Gefahr, dass das andere Auge mit hoher Wahrscheinlichkeit innerhalb der nächsten Jahre ebenfalls erkrankt. Die trockene AMD kann bei 20 – 30 % der betroffenen Patienten in eine feuchte Form übergehen, entsprechend wichtig sind regelmäßige Kontrolluntersuchungen nach Absprache mit Ihrem Augenarzt (mindestens ein- bis zweimal jährlich).
Die feuchte AMD
Der Übergang der trockenen zur feuchten AMD ist durch das Auftreten von unkontrolliert wachsenden, abnormen Gefäßneubildungen in der Aderhaut (choroidale Neovaskularisationen, CNV – Abbildungen 5 & 6) gekennzeichnet. Der grundlegende Prozess, bei dem sich neue Blutgefäße bilden, heißt Angiogenese.
Die Angiogenese ist ein regulierter
Prozess, bei dem durch die Verzweigung und Verlängerung vorhandener
Blutgefäße neue Blutgefäße gebildet werden. Die Angiogenese spielt eine
wichtige Rolle bei vielen normalen (physiologischen) Prozessen wie
Wundheilung, sauerstoffmangel-bedingten (hypoxischen) Schäden und
Fortpflanzung. Bei einigen Krankheiten, wie z.B. Krebs, Arthritis,
Diabetes mellitus und Augenerkrankungen wie feuchter (neovaskulärer,
d.h. mit Gefäßneubildung) AMD besteht jedoch eine fortlaufend gestörte
(deregulierte) Angiogenese.
Die Angiogenese ist durch eine Kaskade
von Ereignissen charakterisiert. Auf eine Gefäßerweiterung und erhöhte
Gefäßdurchlässigkeit folgt der lokale Abbau extrazellulären Gewebes.
Dadurch wird es aktivierten und proliferierenden Endothelzellen
ermöglicht, zu wandern (Migration) und Tuben zu bilden. Es wird
angenommen, dass diese sprossenden Gefäße durch ein Netzwerk aus
differenzierten periendothelialen Zellen und extrazelluläre Matrix
unterstützt werden, ehe die Reifung und Remodellierung der neuen Gefäße
erfolgt (Carmeliet et al, 1996; Folkman & Shing, 1992).
Der
Initialfaktor für die Angiogenese im Auge ist oxidativer Stress
(nährstoffmangelbedingte vermehrte Bildung freier Radikale), der die
Hochregulierung und Expression des vaskulären endothelialen
Wachstumsfaktors A (VEGF-A) und anderer angiogener Faktoren stimuliert.
Dies bewirkt Proliferation und Migration der Endothelzellen, Proteolyse
und Penetration der Basalmembran, gefolgt vom Eindringen der Gefäße
unter die Makula. Der vaskuläre endotheliale Wachstumsfaktor A (VEGF-A)
ist ein wesentlicher Bestandteil Komponente der angiogenen Kaskade und
daher ein wichtiges Ziel für die Behandlung bestimmter Stadien der
feuchten AMD (Das & McGuire, 2003; Witmer et al, 2003).
VEGF-A
ist ein Wachstumsfaktor mit unterschiedlichen Eigenschaften, er fördert
die Zellteilung von Endothelzellen, er ist entscheidend für das
Überleben neu entstandener Gefäße, und er ist ein chemotaktischer Faktor
für Entzündungszellen. Zusätzlich ist er noch unter einem anderen Namen
– vaskulärer Permeabilitätsfaktor (VPF) – bekannt, da VEGF-A die
Durchlässigkeit (Permeabilität) der Blutgefäße reguliert.
VEGF-A hat
eine Affinität zu zwei VEGF-A-Rezeptoren (VEGFR), die sich auf der
Oberfläche der Endothelzellen befinden: VEGFR-1 und VEGFR-2 (Keyt et al,
1996; Ferrara and Davis-Smyth, 1997). Die Bindung des VEGF-A an diese
Rezeptoren führt zum Wachstum von Endothelzellen und zu Veränderungen
der Verbindungen zwischen den Endothelzellen (sog. „tight junctions“;
Aiello et al, 1995; Ozaki et al, 2000), wodurch die Dichtigkeit der
Gefäße weiter reduziert wird (Antonetti et al, 1999).
Wenn diese
Prozesse nicht reguliert werden, wachsen abnormale Blutgefäße von der
Aderhaut aus durch das retinale Pigmentepithel. Diese abnormalen neuen
Blutgefäße sondern Flüssigkeit und/oder Blut ab, wodurch das retinale
Pigmentepithel abgehoben wird. Dies kann sich wiederum als verzerrte
Sicht (Metamorphopsien), zentraler Gesichsfeldausfall (Zentralskotom)
oder Unfähigkeit, mit dem erkrankten Auge lesen zu können, darstellen.
Als
Folge des Austritts von Blut und Flüssigkeit aus den Gefäßneubildungen
der Aderhaut unter die Macula entsteht eine Narbe und damit ein
weitgehender und irreversibler Funktionsverlust des betroffenen Gewebes
(Sehverlust).

Links: Schematische Darstellung der Netzhautveränderungen und Fundusaufnahme eines Auges mit feuchter (neovaskulärer, exsudativer) AMD. Kennzeichen der feuchten AMD ist das unkontrollierte Wachstum abnormer Aderhautgefäße unter und in die Makula
Rechts: Fundusaufnahme eines Auges mit feuchter (neovaskulärer, exsudativer) AMD mit Blut- und Flüssigkeitsaustritt aus abnormalen Aderhautgefäßen
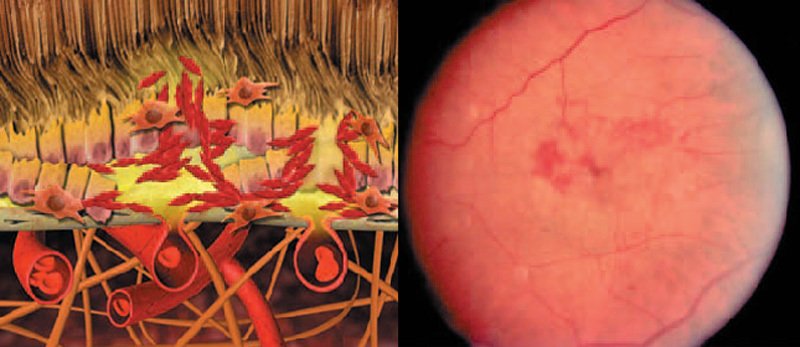
Links: Schematische Darstellung von Netzhautveränderungen eines Auges mit Gefäßundichtigkeit und scheibenförmiger Narbenbildung bei feuchter AMD
Rechts: Fundusaufnahme von Netzhautveränderungen eines Auges mit Gefäßundichtigkeit und scheibenförmiger Narbenbildung bei feuchter AMD
Verlauf der AMD
Der Verlauf der AMD hängt davon ab, ob eine trockene oder feuchte AMD besteht.
Die
feuchte AMD ist die Form, die das Sehvermögen wesentlich stärker
bedroht. Der Verlauf ist schneller und aggressiver. Jedoch ist diese
Form auch sehr viel seltener: Von den über 60-Jährigen sind ca. 5 % von
einer feuchten AMD betroffen.
Die trockene AMD schreitet meist langsamer – manchmal über Jahre – fort. Die trockene AMD kann in die feuchte AMD übergehen.
Das
Fortschreiten (die Progression) der AMD ist komplex und kann den
Übergang von der trockenen (nicht-neovaskulären) zur feuchten
(neovaskulären, exsudativen) AMD mit Auftreten von Gefäßneubildungen der
Aderhaut (choroidalen Neovaskularisationen, CNV) und assoziierten
anatomischen Veränderungen in der Netzhaut und dem retinalen
Pigmentepithel einschließen.
Die Entstehung einer scheibenförmigen
(disziformen) Narbe ist die Folge des Austritts von Blut und Flüssigkeit
aus den Gefäßneubildungen der Aderhaut unter und in die Makula
(Abbildungen 7 & 8). Diese Narbe stellt sich gewöhnlich als weiße
oder gelblich-weiße, fibröse, im Allgemeinen runde und erhabene Läsion
dar. Frische Blutungen am Rand der Narbe deuten auf eine rezidivierende
oder persistierende Gefäßneubildung der Aderhaut hin.
Das
Fortschreiten der AMD kann rapide verlaufen. In klinischen Studien waren
zu Beginn 2,9 % der nicht behandelten Patienten nicht imstande zu
lesen, nach 3 Monaten stieg die Zahl auf 13,4 % und nach 24 Monaten auf
46,3 % (Macular Photocoagulation Study Group, 1991).
Im Verlauf der AMD kommt es im zentralen Gesichtsfeld zunehmend zu einem verzerrten und verschwommenen Seheindruck.
Bei
etwa 40 % der Patienten mit feuchter AMD in einem Auge entwickelt sich
diese Krankheit über einen Zeitraum von 5 Jahren wahrscheinlich auch im
anderen Auge (Macular Photocoagulation Study Group, 1993).
Lesen,
Gesichter erkennen und alltägliche Aufgaben wie Einkaufen oder
Autofahren können bei fortgeschrittener AMD nicht mehr bewältigt werden
und schränken die Selbstbestimmung ein.
Im Außenbereich des Gesichtsfeldes bleibt das Sehvermögen erhalten, zu einer vollständigen Erblindung kommt es nicht.
Um
die AMD, idealer weise vor Eintritt einer Funktionseinschränkung, aber
auch um Verschlechterungen rechtzeitig zu erkennen bzw. den Übergang
einer trockenen in eine feuchte AMD zeitnah festzustellen, sind
regelmäßige Kontrolluntersuchungen bei einem wichtig.
Frühzeichen der AMD
Im
Anfangsstadium merkt der Patient meist nichts, die AMD verläuft
schmerzlos. Die Sehschärfe des betroffenen Auges ist anfangs häufig nur
gering oder gar nicht eingeschränkt, obwohl bereits ein deutlicher und
fortschreitender Verlust des retinalen Pigmentepithels (Vorstufe der
AMD) bestehen kann. Selbst bei abnehmender Sehkraft, also wenn sich die
Krankheit bereits in einem Funktionsverlust eines Auges bemerkbar macht,
sorgt das gesunde Auge häufig für einen Ausgleich der Ausfälle am
erkrankten Auge, so dass die betroffenen Patienten eine AMD oft erst in
einem späten Stadium bemerken.
Eine regelmäßige Kontrolle des
Augenhintergrundes durch einen Makulaspezialisten ist deshalb ab dem 50.
Lebensjahr besonders wichtig. Die ärztliche Kunst besteht hier darin,
frühzeitig geringste Veränderungen im retinalen Pigmentepithel zu
erkennen, mögliche andere Ursachen, Erkrankungen und/oder Degenerationen
auszuschließen und mit den betroffenen Patienten frühzeitig d.h.
möglichst vor Eintritt einer Funktionseinschränkung, also vor Abnahme
der Sehfähigkeit, die jeweils bestmöglich Therapie durchzuführen um so
einem fortschreitenden Verlust der Sehfähigkeit vorzubeugen. Je früher
eine AMD erkannt wird, desto besser sind die Chancen, das Fortschreiten
dieser Erkrankung durch eine geeignete individuelle form- und
stadienabhängige Therapie ohne oder mit nur geringer Seheinschränkung
aufzuhalten.
Ein bereits eingetretener Sehverlust lässt sich meist
nicht mehr rückgängig machen, da in diesem Stadium der Erkrankung die
für den Sehvorgang erforderlichen Sinneszellen bereits abgestorben sind.
Zeichen der fortgeschrittenen (klinisch manifesten) AMD
Verschwommenes, unscharfes Sehen
Verzerrte Bilder (so genannte Metamorphopsien)
Gerade Linien erscheinen gebogen
Zunehmende Probleme beim Lesen und bei der Anpassung an Dunkelheit
Farben erscheinen schwächer
Eingeschränkte (grauer Fleck) oder fehlende (schwarzer Fleck) Sehwahrnehmung im Zentrum des Gesichtsfeldes (sog. Skotome)
Risikofaktoren
Alter
Ab dem 60. Lebensjahr leidet ca. jeder Vierte an einer trockenen AMD. Etwa 18 % der Menschen zwischen 70 und 74 Jahren haben eine Form der AMD. Bei den über 85-Jährigen haben 47 % eine AMD. In ca. 90 % der Fälle liegt eine trockene AMD vor. Mit 55 – 64 Jahren haben 0,1 % eine feuchte AMD, ab 85 Jahren erhöht sich dieser Wert auf 7 % (Ferris et al, 1984; Klein et al, 1992; Vingerling et al, 1995).
Genetik
Geschlecht
Bei Berücksichtigung aller Formen der AMD sind Männer und Frauen zu etwa gleichen Anteilen betroffen, die feuchte Form der AMD kommt jedoch häufiger bei Frauen vor, besonders ab einem Alter von über 75 Jahren (Klein et al, 1997).
Zigarettenkonsum
Zigarettenrauch erhöht dosisabhängig das Risiko an einer AMD zu erkranken.
Raucher, die zurzeit ungefähr 20 oder mehr Zigaretten am Tag rauchen, haben im Vergleich zu Personen, die nie geraucht haben, ein 23fach erhöhtes Risiko, an AMD mit Verlust des Sehvermögens zu erkranken (AREDS Study Research Group, 2000).
Ethnische Herkunft
Irisfarbe
Es gibt Hinweise darauf, dass Menschen mit einer hellen Irisfarbe häufiger an einer AMD erkranken.
Ernährung mit wenig Antioxidantien
Die Prävalenzrate der AMD ist etwa doppelt so hoch bei Patienten, die nur geringe Mengen von Antioxidantien und Lutein zu sich nehmen, im Vergleich zu Patienten, die einen hohen Anteil von Antioxidantien und Lutein zu sich nehmen (Oshinskie, 1996; AREDS Study Research Group, 2001 – Wirkstoffe siehe oben).
Hohe Cholesterinwerte (Vingerling et al, 1995)
Bluthochdruck (AREDS Study Research Group, 2000)
Kardiovaskuläre Erkrankungen (AREDS Study Research Group, 2000)
UV-Licht (Nilsson et al, 2003; Rezai et al, 2008)
Lebensqualität bei AMD
Schätzungen besagen, dass eine leichte AMD eine 17%ige Verringerung der Lebensqualität verursacht. Bei mittelschweren und schweren Formen der AMD reduziert sich die Lebensqualität auf 40 % bzw. um mehr als 60 % (Brown et al, 2005).
Die AMD wird von Patienten als ebenso einschränkend beschrieben wie andere chronische behindernde Erkrankungen, wie z.B. Arthritis, chronisch obstruktive Lungenkrankheit und AIDS (Acquired Immune Deficiency Syndrome) (Williams et al, 1998; Brody et al, 2001).
Untersuchungen bei AMD
Optische Kohärenztomographie (OCT, zur Bestimmung des Netzhautzustandes und der Netzhautdicke)
Fundus-Befunddokumentation (Fotografie)
Gefäßdarstellung (Angiographie – mit Fluoreszein- oder Indocyaningrün zur Darstellung der Blutgefäße
erforderlich werden.
In der Regel erfolgt zunächst eine Befunddokumentation mit einer Spezialaufnahme (Optische Kohärenztomografie, OCT), anschließend wird eine Fluoreszenzangiographie durchgeführt. Die Fluoreszenzangiographie, eine spezielle Farbstoffuntersuchung, hilft bei der Differenzierung (Form und Stadium) der AMD, anormales Gefäßwachstum kann erkannt und beurteilt werden. Bei Verdacht auf eine bestimmte Form der feuchten AMD kann eine Gefäßdarstellung mit einem anderen Farbstoff, Indocyaningrün, hilfreich sein.
Die optische Kohärenztomographie, ein schmerzfreies, dreidimensionales Laserverfahren zur kontaktlosen, hochauflösenden Schichtuntersuchung, ermöglicht, mikrostrukturelle Veränderungen der Makula zu erkennen. Durch Kombination von Angiographie und optischer Kohärenztomographie kann der Makulaspezialist bestimmte krankhafte Strukturen im lebenden Auge erkennen und damit Art und Umfang der krankhaften Ablagerungen von Stoffwechselendprodukten genau berechnen und analysieren. Dies erlaubt es, den individuellen Verlauf der AMD einzuschätzen und den Therapieerfolg zu überprüfen.
Behandlungen
Wichtigstes Ziel bei der Behandlung der AMD ist es, den natürlichen Verlauf der Erkrankung (frühzeitig, am besten vor dem Beginn des Sehverlustes, d.h. bei beginnenden Veränderungen im retinalen Pigmentepithel) aufzuhalten und möglichst viel Sehvermögen zu erhalten.
Hier hat sich bei Nichtrauchern die Zufuhr bestimmter, hochwertiger, nicht hitzestabilisierter Wirkstoffe mit hoher Bioverfügbarkeit (DL-alpha-Liponsäure, Zeaxanthin, Lutein, Levocarnitin, Pantothensäure, Pyridin-3-Carbamid, Thiamin, Riboflavin, 3-Hydroxy-2-Methylpyridine, Vit. B6, Pteroyl-Glutaminsäure, Biotin, Cyanocobalamin) bewährt (Age-Related Eye Disease Study Research Group, 2007; Briganti et al, 2008; Feher et al, 2005; Kim et al, 2008; Johnson et al, 2008; Parisi et al, 2008; Zulkhairi et al, 2008)
Darüber hinaus hängt die Behandlung der AMD von der vorliegenden Form (trockene oder feuchte AMD) und dem Stadium der Erkrankung ab.
Behandlung der trockenen AMD
Bei bestimmten Frühformen der trockenen AMD kann zusätzlich zur Zufuhr der o.g. Wirkstoffe die Rheopherese hilfreich sein.
Rheopherese bei AMD
Wissenschaftliche
Studien zeigten, dass über die Therapie mit bestimmten Wirkstoffen
(s.o.) hinaus die Verbesserung der Fließeigenschaften des Blutes
Patienten mit trockener AMD helfen kann (Brunner et al, 2000; Kirchhof
2004; Klingel et al, 2003; Klingel et al, 2006; Pulido et al, 2005).
Diese
Therapie wird als Rheopherese bezeichnet. Ziel der Rheopherese ist es,
die zentrale Sehkraft zu stabilisieren bzw. zu verbessern.
Die
Rheopherese stellt eine Behandlung des Blutes außerhalb des Körpers dar.
Die Blutbehandlung entspricht einem Filtrationsverfahren, durch das
bestimmte Blutbestandteile, z.B. einige Fette und Eiweiße, entfernt
werden, die sich nachteilig auf die Blutfließeigenschaften auswirken.
Danach erhält der Patient sein eigenes, „gereinigtes“ Blut zurück.
Fremde Blutbestandteile werden nicht verwendet. Es gibt eine Reihe von
ähnlichen Verfahren einer Blutbehandlung außerhalb des Körpers, die im
Zusammenhang mit Nieren- und Stoffwechselerkrankungen seit Jahrzehnten
routinemäßig eingesetzt werden.
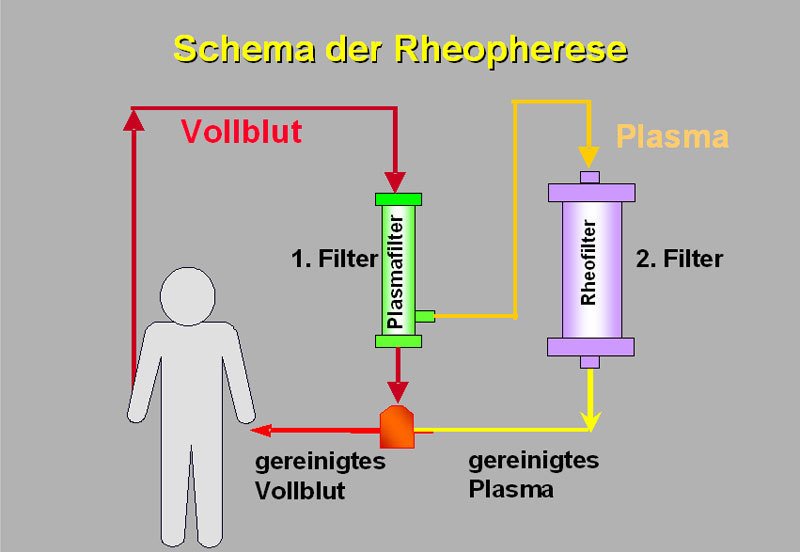
Eine Rheopherese-Behandlung dauert ca. 2-3 Stunden. Während dieser Zeit liegt der Patient bequem im Bett. Es werden an den Armen zwei Venen punktiert, um einen Zugang zum Blutkreislauf zu schaffen. Das Blut wird aus einer Vene in einem Schlauchsystem durch zwei Filter geleitet (s. Abbildung 9). Dabei befindet sich in dem geschlossenen Kreislauf immer nur eine begrenzte Menge Blut außerhalb des Körpers. Schlauchsystem und Filter sind sterile Einmalprodukte. Das gereinigte Blut wird über die zweite Vene in den Körper zurückgegeben.
Behandlung der feuchten AMD
In
der Vergangenheit wurde die feuchte AMD mit Laserphotokoagulation,
Strahlentherapie oder chirurgischen Verfahren behandelt. Die Ergebnisse
dieser Methoden waren häufig unbefriedigend. Neuere pharmakologische
Ansätze, wie Verteporfin (Visudyne®) im Rahmen der photodynamischen
Therapie (PDT) oder Pegaptanib-Natrium (Macugen®), ein
anti-VEGF-A165-RNA-Aptamer, führten zu beständigeren Ergebnissen, häufig
konnte eine Stabilisierung der Sehkraft erreicht werden, die als
Verlust von weniger als 15 Buchstaben auf der ETDRS-(Early Treatment
Diabetic Retinopathy Study)-Tafel definiert ist.
Neuere
VEGF-Antagonisten (z.B. monoklonale Antikörper-Fab-Fragmente) hemmen
spezifisch die gestörte (deregulierte) Angiogenese, also den
Grundmechanismus für das Wachstum krankhafter Gefäße in der Aderhaut.
Entsprechend kann der im retinalen Pigmentepithel und den Sinneszellen
(Photorezeptoren) zu Schädigung, Narbenbildung und dann zu irreversiblem
Sehverlust führende Austritt von Blut und Flüssigkeit aufgehalten bzw.
unterbunden werden.
Der Wirkungsmechanismus basiert auf der Blockade
der Rezeptoren des vaskulären endothelialen Wachstumsfaktors A (VEGF-A)
an der Oberfläche der Endothelzellen, die die Blutgefäße der Aderhaut
bilden. Bei der feuchten AMD sind die VEGF-A-Werte erhöht. Die
Regulierung dieses Wachstumsfaktors verhindert u.a. die Kaskade von
Abläufen, die zur Bildung von Gefäßneubildungen der Aderhaut und
Flüssigkeitsaustritt führen.
Aktuelle, randomisierte, kontrollierte
Phase-III-Studien (MARINA und ANCHOR) zeigten eine verbesserte
durchschnittliche Sehschärfe während der ersten drei Behandlungsmonate,
die über die gesamte Behandlungsperiode aufrecht erhalten werden konnte.
Ursächlich scheint eine schnelle und nachhaltige Reduzierung von
Netzhautschwellung und Flüssigkeitsaustritt zu sein.
Das natürliche
Fortschreiten der feuchten AMD bis zur Blindheit (im Sinne des Gesetzes)
kann durch diese Therapie meist verhindert werden.
Die Therapie
beginnt mit einer Aufsättigungsphase (Upload) von drei Injektionen der
antiproliferativen Substanz (VEGF-Inhibitor) in den Glaskörperraum
(intravitreal) des betroffenen Auges in monatlichem Abstand, gefolgt von
einer Erhaltungsphase, in welcher die Sehschärfe der Patienten
monatlich kontrolliert wird. Je nach Befund können weitere Injektionen
erforderlich werden.
Ein Vorteil der Injektion in das Auge ist, dass
der Wirkstoff direkt an die Makula gelangt, also den Ort, an dem er
wirken soll. Würde der Patient den Wirkstoff in Form von Tabletten
einnehmen, müsste eine wesentlich höhere Dosis eingenommen werden, da
die Makula nur geringe Mengen der Substanz aus dem Blut aufnimmt.
Darüber hinaus wäre der gesamte Körper dem höher dosierten Wirkstoff
ausgesetzt, es könnte zu Nebenwirkungen kommen.
Die Injektion kann
ambulant durchgeführt werden, sie muss unter kontrollierten, sterilen
Bedingungen (im OP) erfolgen, der Patient sollte 3 Tage vor und nach der
Injektion antibiotische Augentropfen verwenden. Eine befundangepasste
augenärztliche Kontrolle sollte für die Dauer von einer Woche nach der
Injektion, auch bei Beschwerdefreiheit, erfolgen.
Es kann im
Anschluss an die Injektion ins Auge zu verschwommenem Sehen kommen. Nach
dem Eingriff sollte der Patient keine Fahrzeuge lenken und keine
Maschinen bedienen, solange dieses Symptom anhält.
Bei Zeichen, die
auf eine Entzündung hindeuten (Rötung des Auges, Schmerzen oder
Lichtempfindlichkeit, Änderung des Sehvermögens) sollte der Patient
sofort Kontakt mit dem behandelnden Makulaspezialisten aufzunehmen.
Eigenvorsorge bei AMD
Es gibt keinen perfekten Schutz vor AMD.
Folgende Verhaltensweisen können aber einer AMD vorbeugen:
- Sonnenbrille mit 100% UV-Schutz und breiten Bügeln, damit auch von der Seite kein UV- Licht in Ihre Augen gelangen kann
- Regelmäßige Kontrolluntersuchungen Ihres Augenhintergrundes
- Selbsttest Ihres Sehvermögens regelmäßig mit dem sog. Amsler-Gitter
- Entsprechende Wirkstoffe, darunter Antioxidantien (nicht bei Rauchern)
- Rauchverzicht
- Ausgewogene Ernährung (Obst, Gemüse, Fisch)
- Kontrolle Ihres Blutdruckes durch Ihren Hausarzt, ggf. Blutdruckeinstellung
- Kontrolle Ihres Blutfettprofiles durch Ihren Hausarzt, ggf. Senkung Ihrer Blutfette
Jegliche Veränderungen Ihres Sehvermögens sollte so früh wie möglich erkannt und ggf. behandelt werden.
Wie
bereits erwähnt, kann die AMD nicht geheilt, häufig aber aufgehalten
bzw. verzögert werden. Daher ist eine frühzeitige Diagnose und Therapie
besonders wichtig. Sollte bereits eine Vorstufe der AMD oder eine
manifeste AMD vorliegen, ist eine „gesunde“ Ernährung allein nicht
ausreichend und meist eine Therapie erforderlich.
Liegt bei Ihnen
bereits eine klinisch manifeste AMD vor, ist es wichtig, den Übergang
von einer trockenen in eine feuchte AMD frühzeitig zu erkennen, um Ihre
Behandlung rechtzeitig zu ergänzen bzw. umzustellen.
Kontrolluntersuchungen bei AMD
Kontrolluntersuchungen sollten Sie mit Ihrem behandelnden Maculaspezialisten abstimmen. In der Regel sind Kontrollen mindestens ein- bis zweimal jährlich erforderlich. Liegt bereits eine feuchte Form der AMD vor, sollten Sie in der Regel alle drei bis vier Monate zur Kontrolle gehen. Bei Änderungen Ihres Sehvermögens (Amslertest – s.o.) sollte eine zeitnahe Kontrolle erfolgen.
Ausgewählte Literatur
Trockenes Auge
Das trockene Auge (Keratoconjunctivitis sicca, Benetzungsstörung)
PD Dr. med. Karl-Georg Schmidt
Bei
dem „Trockenen Auge“ wird zwischen dem „feuchten trockenen Auge“, d.h.
der evaporativen Form (evaporative dry eye) und der durch den
Tränenflüssigkeitsmangel bedingten Form (hypovolämisch, aqueous
tear-deficient dry eye) unterschieden .
Bei der evaporativen Form
liegt meist eine Schädigung bestimmter Drüsen im Lidbereich vor, die
bestimmte Bestandteile (Lipide) zur Stabilisierung des Tränenfilms
produzieren (Meibom-Drüsen). Als Folge ist die Lipidschicht des
Tränenfilms so verändert, dass der wässrige Anteil der Tränenflüssigkeit
vermehrt verdunstet. Bei beiden Formen des trockenen Auges liegt eine
Funktionsstörung des Tränenfilms vor, die zu einer zunehmenden
chronischen Entzündung der Augen führen kann.
Werden die mangelnde
Tränensekretion bzw. die Veränderungen in der Zusammensetzung der
Tränenflüssigkeit nicht behandelt, verstärken sich die entzündlichen
Prozesse und können zu verschiedenen Beschwerden, einer Schädigung des
Gewebes und damit zu erheblichen Einschränkungen der Lebensqualität
führen.
Typische Beschwerden
Sehstörungen
Blendung
Druckgefühl
Brennen
Rötung
Fremdkörpergefühl
Schmerzen
Lidschwellung
Müde Augen
Typische Ursachen
Kontaktlinsen
Bildschirmtätigkeit („office eye syndrome“)
Reduzierte Luftfeuchtigkeit
Allergien
Erkrankungen (z.B. Rheuma, Rosazea)
Hormonelle Umstellung (Wechseljahre)
Medikamente (z. B. hormonelle Kontrazeption – „Pille“, Betablocker, Antihistaminika)
Untersuchungen
Untersuchung der Augenoberfläche und Lidränder mit dem Biomikroskop
Messung der Tränenfilmaufreißzeit
Fluoreszeinprobe (Prüfung auf Schäden an der Augenoberfläche)
Schirmer-Test (Erfassung der Tränenmenge)
Behandlung
Falls
Sie unter Fremdkörpergefühl, brennenden, geröteten, trockenen oder
stark tränenden Augen leiden, sollte unbedingt einen Augenarzt
aufsuchen.
Es wird heute davon ausgegangen, dass sich die beiden
Hauptkategorien des Trockenen Auges, nämlich die evaporative Form und
die durch Tränenflüssigkeitsmangel bedingte Form, durch
Wechselwirkungen, die im Laufe der Zeit auftreten, jeweils zu einer
kombinierten Form entwickeln und den Schweregrad des Trockenen Auges
verstärken können .
Für die Therapie entscheidend ist Ihr subjektives
Empfinden, Ziel unserer Therapie ist stets Ihre möglichst weitreichende
Beschwerdefreiheit.
In unserer täglichen Praxis hat sich eine
Kombinationstherapie aus konservierungsmittelfreien Tränenersatzmitteln,
Gels, ggf. ergänzend Salben und Sprays sowie ggf. Omega – 3 –
Fettsäuren bestens bewährt, die Augenoberfläche wird vermehrt
befeuchtet, die Qualität des Tränenfilms nimmt zu.
Diese
Kombinationstherapie bietet die Sicherheit beide Aspekte, nämlich
Verdunstung und Flüssigkeitsmangel, adäquat zu behandeln. Die
tatsächliche Gewichtung der Präparate innerhalb der Therapie richtet
sich nach Ihren individuellen Beschwerden.
Die jeweilige
Kombinationstherapie passen wir gemeinsam mit Ihnen auf Ihre jeweiligen
Bedürfnisse an. Sollten Ihre Präparate u.a. auch für das
Kontaktlinsentragen geeignet sein , sollte das Tränenersatzmittel vor
diesem Hintergrund sowohl phosphatfrei als auch konservierungsmittelfrei
sein .
Weitergehende Behandlungen wie der Verschluss der Tränenwege
z.B. durch Einsetzen von Punctum Plugs) oder eine lokale Suppression der
zugrundeliegenden entzündlichen Prozesse (Cyclosporin A) sind selten
erforderlich.
Was können Sie selbst tun?
Zugluft meiden
Gebläse (z.B. im Auto) nicht auf die Augen richten
Verrauchte Räume meiden
Luftbefeuchter nutzen
Reizarme Kosmetik anwenden, ggf. regelmässige Lidrandreinigung
Tragen einer sog. Siccabrille z.B. beim Skifahren und Radfahren
Literatur
Definition und Klassifikation des Trockenen Auges: Bericht des Unterausschusses für Definition und Klassifikation des International Dry Eye WorkShop 2007; 5: 75-92
Brewitt H, Rüfer F. Das trockene Auge. Klin Monatsbl Augenheilkd 2004; 221: R51-R70
Auw-Hädrich C, Reinhard T. Chronische Blepharitis. Ophthalmologe 2007; 104: 817-828
Dausch D, Lee S, Dausch S, Kim JC, Schwert G, Michelson W. Vergleichende Studie zur Therapie des Trockenen Auges bedingt durch Lipidphasenstörungen mit lipidhaltigen Tränenpräparaten. Klin Monatsbl Augenheilkd 2006; 223: 974-983
Maus M, Hanneken L. Trockenes Auge nach LASIK – erfolgreiches Management für Therapieerfolg und Patientenzufriedenheit. Ophthalmo-Chirurgie 2007; 19(Suppl. 3): 1-4
Lohmann CP, Lindenschmid A, Maier M, Specht H. New topical medication to prevent dry eye. Cataract & Refractive Surgery Today, January/February 2008, (Insert): 1-8
Lange W, Ladwig KJ, Reich W. Benetzungsstörungen nach Kataraktoperationen. Z. prakt. Augenheilkd. 29 (Suppl. 3): 1 – 8 (2008)
Künzel P. Die Behandlung des kontaktlinsenbedingten Trockenen Auges. Kontaktlinse 2008; 41 (10): 4-10
Khaireddin R, Schmidt KG. Vergleichende Untersuchung zur Therapie des evaporativen trockenen Auges. Klin Monatsbl Augenheilkd. 2009 Sep 15.
Lakomy U, Ruob C, Hersberger K, Beutler M. Gesucht – das beste Tränenersatzmittel. Schweizer Apothekerzeitung, 13/2006: 509-515
Schielen (Strabismus)
Was ist Schielen?
Von
Schielen (Strabismus) spricht man, wenn eine ständige oder immer wieder
auftretende Fehlstellung eines oder beider Augen vorliegt. Beide Augen
schauen nicht in die gleiche Richtung.
Schielen kann in allen Richtungen, auch kombiniert, auftreten: Innenschielen, Aussenschielen und Höhenschielen.
Schielen
ist nicht nur ein Schönheitsfehler, sondern kann ohne Behandlung zu
schweren Sehbehinderungen führen. Schielen führt dazu, dass ihr Kind nur
eines seiner beiden Augen aktiv zum Sehen benutzt. Dadurch kann sich
die Sehschärfe am schielenden Augen nicht entwickeln. Es entsteht eine
Sehschwäche. Der Fachbegriff hierfür lautet: Amblyopie. Wird eine
Amblyopie im Kindesalter nicht rechtzeitig erkannt und behandelt, bleibt
sie ein Leben lang bestehen. Die Amblyopie verhindert das richtige
beidäugige Sehen (Dreidimensionale Sehen), die Unfallgefahr steigt an
und es besteht eine Einengung der Berufswahl.
Die Ausreifung der
Sehschärfe und die Zusammenarbeit der Augen entwickeln sich in den
ersten Lebensmonaten enorm, sind allerdings bis zum Alter von zirka 8
Jahren noch verstärkt störungsanfällig und ist erst mit der Vollendung
der Pubertät abgeschlossen.
Für eine erfolgreichere Behandlung von
kindlichen Sehstörungen ist eine Früherkennung besonders wichtig! Denn
je früher die Sehbehinderung entdeckt und therapiert wird, desto besser
stehen die Chancen, eine volle Sehschärfe zu erreichen und Dauerschäden
können erfolgreicher behandelt werden (bereits ab dem sechsten
Lebensmonat möglich).
Daher raten die Fachgesellschaften der
Augenärzte und Orthoptistinnen zu Vorsorgeuntersuchungen im ersten,
dritten bis vierten und sechsten Lebensjahr, auch wenn keine
Auffälligkeiten bestehen.
Schielformen
Ein
manifestes, also ständig vorhandenes und häufig angeborenes Schielen
bzw. in den ersten Lebensmonaten entstandenes Schielen ermöglicht keine
oder nur eine geringe Zusammenarbeit der Augen.
Neben dem
offensichtlichen Schielen gibt es noch das versteckte (latente)
Schielen, dass ebenfalls in alle Richtungen auftreten kann, jedoch meist
eine gute beidäugige Zusammenarbeit zulässt. Dieses latente Schielen
haben ca. 80% aller Menschen und verursacht meistens keine Beschwerden.
Belastet das latente Schielen die beidäugige Zusammenarbeit zu sehr, so
kann es doch zu Beschwerden kommen, die augenärztlich-orthoptisch
untersucht und behandelt werden können und sollten.
Eine Sonderform
und besonders wichtige Schielform ist der so genannte Mikrostrabismus.
Hierbei ist der Schielwinkel so klein, dass man ihn mit blosem Auge
nicht erkennen kann. Deshalb wird die Sehbehinderung bei dieser
Schielform meistens erst spät entdeckt.
Folgende
Beobachtungen lassen auf ein Abweichen der normalen Entwicklung des
Auges schliessen und sollten unbedingt abgeklärt werden:
Schielen ab dem 6. Lebensmonat (ein Schielen wächst sich NIE aus)
Augenzittern
Schiefhalten des Kopfes
Vorbeigreifen
Ungeschicklichkeiten (Stolpern, Anstossen)
Lesen mit der Nase
Unlust am Lesen
Lesestörungen
häufiges Blinzeln, Zwinkern, Zukneifen
Konzentrationsprobleme
Doppelbilder
Kopfschmerzen
Augenbrennen
oft gerötete Augen
tränende Augen
Verschwommensehen
Schielt mein Baby?
In den ersten Lebenswochen bis hin zum 3. Lebensmonat ist häufig ein Schielen bei Säuglingen zu beobachten, da die Augenbewegungen noch nicht ausreichend koordiniert sind. Ein auffälliges Schielen nach dem 3. Lebensmonat sollte augenärztlich-orthoptisch abgeklärt werden.
Häufig handelt es sich um einen „Pseudostrabismus“. Aufgrund des noch kindlich breiten und flachen Nasenrückens entsteht bei nur geringem Blick zur Seite schon der Eindruck des Schielens. Auch hier kann eine augenärztlich-orthoptische Untersuchung ein richtiges Schielen ausschliessen.
Behandlung des Schielens
Zunächst erfolgt eine eingehende augenärztliche-orthoptische Untersuchung zur Feststellung der Art, des Umfangs und der Ursache des Schielens oder der Sehbehinderung. Zu dieser Untersuchung gehört unerlässlich eine objektive Bestimmung der Brechkraft des Auges (Weitsichtigkeit, Kurzsichtigkeit oder Hornhautverkrümmung) mittels harmloser Augentropfen. Dem Ergebnis dieser Untersuchung entsprechend wird ggf. eine Brille verordnet.
Mein Kind bekommt eine Brille - Worauf mmuss ich bei der Wahl einer Kinderbrille achten?
Wesentlich ist der komfortable, aber feste Sitz. Dazu gehören Sportbügel, eine weicher Silikonnasensteg und Kunststoffgläser.
Die Fertigung einer solchen Brille stellt hohe Anforderungen an das Optikerhandwerk. Lassen Sie sich gut beraten. Erlauben Sie ihrem Kind, seine Brille selbst mit auszusuchen. Im Augenzentrum Höfe stehen Ihnen besonders erfahrene Augenoptiker zur Verfügung.
Fördern Sie eine positive Einstellung zur Brille!
Wird Ihr Kind die Brille akzeptieren?
In den meisten Fällen akzeptieren Kinder ihre neue Brille nach anfänglicher Gewöhnungsphase recht gut. Die Gewöhnung an eine neue Brille kann jedoch bis zu vier bis sechs Wochen dauern.
Okklusionsbehandlung
Bei einer bereits bestehenden Sehschwäche (Amblyopie) wird eine Okklusionsbehandlung erforderlich, die sich über mehrere Jahre hinziehen kann. Das nicht schielende, besser sehende Auge wird in der Regel mit einem Augenpflaster oder mit einer Abdeckung auf der Brille abgeklebt.
Der Erfolg der Behandlung ist wesentlich von der guten und vertrauensvollen Zusammenarbeit zwischen Patient, Eltern, Augenarzt, Orthoptistin und Augenoptiker abhängig! Im Augenzentrum Höfe stehen Ihnen und Ihrem Kind ein erfahrenes und eingespieltes Team zur Verfügung.
Schwachsichtigkeit (Amblyopie)
Schwachsichtigkeit (Amblyopie) bezeichnet die Sehschwäche eines, seltener beider Augen, die aufgrund einer Unterentwicklung des Sehsystems in der frühen Kindheit entsteht. Die Amblyopie ist meist mit einer Fehlsichtigkeit (Weit- oder Kurzsichtigkeit, Hornhautverkrümmung) kombiniert.
Eine Fehlsichtigkeit kann mit einer optischen Korrektur (Brille oder Kontaktlinsen) ausgeglichen werden. Bei der Amblyopie bleibt die Sehverminderung auch mit optimal angepasster Brille oder entsprechenden Kontaktlinsen bestehen.
Wenn also ausschliesslich eine Fehlsichtigkeit (ohne Amblyopie) besteht, kann der Sehfehler mit einer entsprechend angepassten Brille und / oder Kontaktlinsen korrigiert werden.
Leitsymptom der Amblyopie ist eine ein- oder beidseitige Verminderung der Sehschärfe. Neben der Verschlechterung der zentralen Sehschärfen treten auch sog. Trennschwierigkeiten auf, die zu erheblichen Problemen beim Lesen führen können. Zusätzlich können Störungen des räumlichen Sehens auftreten.
Die häufigsten Risikofaktoren für eine Amblyopie sind:
Schielen
unterschiedliche Fehlsichtigkeiten
familiäre Häufigkeit
Anomalien des Augenlides
Trübungen der Linse und / oder Hornhaut sowie
Frühgeburt
Eine Amblyopie entsteht meist in der frühkindlichen Entwicklungsphase (zwischen Geburt und 3. + 4. Lebensjahr). Je früher eine Amblyopie auftritt, desto massiver kann sie sein.
Bestimmte Formen der Amblyopie können auch erst später im Kindesalter auftreten (Spät-Amblyopie). Ab dem 13. Lebensjahr tendiert das Risiko einer Amblyopie gegen Null.
Später erworbene
Sehminderungen (z.B. toxische Veränderungen des Sehnerven durch Alkohol
oder Tabak) sind keine Amblyopien, da hier eine Schädigung des Sehnerven
zugrunde liegen.
Die Diagnose einer Amblyopie stellen unsere Orthoptistinnen mit folgenden Tests:
Sehtest
Schieltest
Stereotest
Tests bzgl. Fehlsichtigkeit
Die Untersuchung der vorderen und hinteren Augenabschnitte hinsichtlich Linsentrübungen und / oder Netzhauterkrankungen durch unsere Augenärzte vervollständigt die medizinische Abklärung. Typische Anzeichen, die bei der Untersuchung von Kleinkindern auf eine mögliche Amblyopie hinweisen, sind:
heftige Abwehrbewegungen beim Zuhalten des gesunden Auges oder
häufiges Augenreiben oder Augenkneifen des kranken Auges
Je früher eine Amblyopie erkannt wird, desto besser ist die Prognose für eine erfolgreiche Behandlung. Grundsätzlich sind funktionelle Sehschwächen, die während der ersten Lebensjahre entstehen und nicht früh entdeckt und behandelt werden, mit Erreichen der Pubertät in der Regel nicht mehr heilbar. Daher empfiehlt sich eine routinemässige Vorsorgeuntersuchung in unserer Spezialsprechstunde.
Das Ziel der Behandlung ist die Wiederherstellung einer normalen Sehschärfe. Der erste Schritt der Behandlung ist – im Fall einer zusätzlichen Fehlsichtigkeit – die Korrektur der vorhandenen Brechungsfehler mit einer Brille und / oder Kontaktlinsen. Besteht anschliessend noch immer eine Sehdifferenz, so ist die Diagnose einer Amblyopie gesichert.Der nächste Behandlungsschritt besteht darin, das kranke Auge mit unterstützenden Massnahmen zum Sehen anzuregen. Dabei wird entsprechend der Schwere der Amblyopie das gesunde Auge mit einem Kleber (Abdeckfolie) für ein paar Stunden täglich abgeklebt. Während dieser sog. Okklusion (Abkleben eines Auges) zwingt man das kranke Auge zum Sehen. Somit kann sich die Sehschärfe allmählich zu einer normalen Sehschärfe entwickeln.Die Dauer einer solchen Amblyopiebehandlung ist abhängig von der Schwere der Schwachsichtigkeit, organischen Ursachen und nicht zuletzt auch von der Kooperation des Kindes und der Eltern.
Eine erfolgversprechende Therapie dauert jedoch nicht selten bis zum 12. oder 13. Lebensjahr.